3. 甲醇的解离与碰撞统计
甲醇有两种键断裂方式。用 R 代记甲基 (CH
3)。在一般条件下,25 ℃时,R-OH 断裂能为 387kj/mol,
RO-H 断裂能为436kj/mol,前者较容易断裂。在特定条件下,可以使 RO-H 断裂方式相对于 R-OH 断裂方式发生的机率更大。
这样考虑,其离解后的基团可能有四种:R/OR/OH/H。产物具有结构形式
HaSiRbORcOHd, (a+b+c+d=4, 0≤a,b,c,d ≤4)------(3.1)
進一步假定(R-OH)断键方式的概率为 P
1,(RO-H)断键方式的概率为 P
2, (P
1+P
2=1) 。
则 n 个醇分子离解后产生出 nP
1个 R
- 和 nP
1 个 OH
+, nP
2 个 OR
- 和 nP
2 个 H
+。
把 nP
1简记为 n
1,nP
2 简记为 n
2,则 H
aSiR
bOR
cOH
d 出现的概率为:
P= Can1Cbn2Ccn1Cdn2 / C42n------(3.2)
全部可能的产物共有 35 种。在醇硅直接合成过程中的产物的色谱分析图上可以查到 30 余个特征峰就是证据。
产物出现概率的较好的估计需要这些离子的离子半径,准确数据尚未找到。
解离方式有四种可能:
- 极性解离;
- 催化解离;
- 吸附解离。
- 不发生解离。
笔者现有的认识,本反应中的甲醇需要解离,三种解离方式都可能存在,而溶剂的极性解离作用最大。
因此,极性溶剂是必要的。溶剂除了起悬浮作用之外,最重要的作用是实现和加速甲醇的解离。
如果甲醇不能快速解离,反应不能快速按指定方向进行。
假设某种催化系统能抑制 R-OH 断裂并提高 RO-H 键的断裂概率,这种假设没有坏处。
离开催化剂,本反应几乎不发生。
4. 醇-硅过程的均相反应模型
要设计反应系统,必须设想其反应原理模型,哪怕是简化的,宏观的。
为推导与编程方便,将硅简记作 B
1(不致误会时它就是 B),
H
2B(OR)
2 为 B
2, HB(OR)
3 为 B
3,
B(OR)
4 为 B
4, RB(OR)
3 为 B
5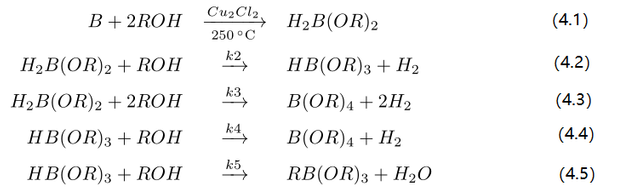
建立微分方程并求解,可以得到一组方程,(微分方程的建立与求解过程及解组放在后面的附录中。)
编写计算代码,假设一组状态参数(反应速率 k
i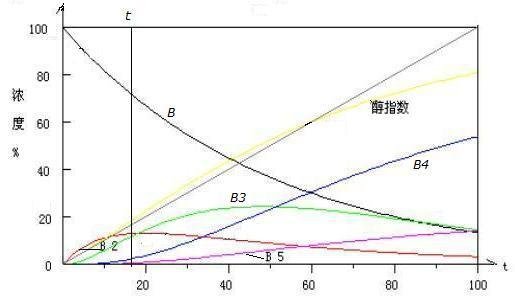
图 4.1 醇-硅过程模拟运行图
全混流反应模型本质上就是这个模式。一个是固体,一个是气体,醇-硅过程当然不是均相的。但是,我们可以借用这个模型了解过程的某些特性。
在某一试验阶段使用这一模型了解过程的基本特性是必要的。后面我们再讨论如何修正这一实验模型。
图 4.1 中的醇指数是 t 时刻 各组分(B
i)所含甲基之和摩尔数计算值,
2B
2+3B
3+4B
4+4B
5。
它与醇的实际供给量(图中左下角至右上角的斜线)不重合,醇的缺失是假的,因为这些速率的模拟是随意假设的而不是测定的。
另一方面,这一现象反映过程的本质。有一个时刻,在这个时刻之前,醇处于饥饿状态,
反应处于激烈的竞争中。之后,竞争相对不激烈,以致逐渐消失。
由图 4.1 很清楚地看出,反应(4.1)-(4.5)是复杂反应,可以分为三组:
第一组:反应主要为(4.1)的
引发生成 B
2;
第二组:
平行反应(4.1)、(4.3)竞争地发生,消耗醇和 B
2 分别生成 B
3 和 B
4;
第三组: B
3 出现之后,平行反应(4.4)、(4.5})发生,又竞争消耗醇和 B
3 ,分别生成 B
4 和 B
5.
组间具有
串反应性质。一旦 B
2,B
3 出现之后,这三组之间又互相竞争。竞争消耗醇和目标产物。组间已失去时序关系,发生恶性竞争。
存在一个时刻 t, B
2 达到最大值, B
3 随后达到最大值。B
3 一旦出现, B
4,B
5 即获得出现的可能,
逐渐出现并迅速增加且不减。一旦 B
5出现,就意味着有水出现了,系统将面临各种麻烦。
反应的控制在于醇。只要有醇,即使没有硅了,反应照样能够继续,直到全部组分变成 B4或 B5。
如果没有醇,即使有再多的硅,反应会立即停止,各种产物的浓度不会继续发生变化。
假定在某一时刻,停止加入醇。在系统逐渐消耗完剩余的甲醇之后,反应会停止。
过程开发的要求是使主产物浓度最高而副产物浓度较低。
其措施只能是选择一个恰当的时刻,停止加入醇使反应停止。将目标产物提取出来后再进入下一反应周期。
附录: 微分方程及其解
为书写方便和便于迭代计算,将硅简记作 B
1 (不至误会时,有时也记作 B),
H
2B(OR)
2 为 B
2, HB(OR)
3 为 B
3,
B(OR)
4 为 B
4, RB(OR)
3 为 B
5 。
在这一组记号下,假设反应器是一个容积足够大足以容纳全部原料和产物的全混釜。
将 M 摩尔硅粉及催化剂加入其中,并且假定每一个硅原子都以平等的身份参与反应。
以等速 v 摩尔/1分钟加入甲醇(ROH),且 v 适当大,使系统能维持 ROH 的浓度 C
Me 为常值,直到反应完成。
5 个反应,相应有 5 个反应速率 k
1,...,k
5 ,需要实验测定。在时刻 t,各组分 B
i 的浓度变化,
从(4.1)-(4.5)可以得到微分方程组
dB
1(t)/dt = -k
1B
1C
Me
2 ------(A.1)
dB
2(t)/dt = -k
1B
1C
Me
2 -B
2C
Me ------(A.2)
dB
3(t)/dt = -k
2B
2C
Me-B
3C
Me(k
4+k
5) ------(A.3)
dB
4(t)/dt = -k
3B
2C
Me
2 +k
4B
3C
Me ------(A.4)
dB
5(t)/dt = k
5B
3C
Me ------ (A.5)
B
i 应当满足关系
B
1+B
2+B
3+B
4+B
5=M ------(A.6)
t=0 时 B
i=0,(i=1,2,3,4,5) 。上述 5 个微分方程只有 4 个是独立的,满足关系
∑dB
i/dt=0
在稳态操作条件下,假定甲醇的加料速度 v 适合使甲醇的浓度 C
Me 是一常数,可并入 k
i 中。
可以将(A.1)- (A.5)重写作
dB
1(t)/dt = -k
1B
1 ------ (A.7)
dB
2(t)/dt = -k
1B
1-B
2 ------ (A.8)
dB
3(t)/dt = -k
2B
2-B
3(k
4+k
5) ------ (A.9)
dB
4(t)/dt = -k
3B
2+k
4B
3 ------ (A.10)
dB
5(t)/dt = k
5B
3 ------ (A.11)
这是一组线性非齐次常微分方程,逐个方程分离变量,应用常数变易法,积分结果如下。
B
1(t) = c
1exp(-k
1t)
c
1 = B
1(0)=M
B
2(t) = -c
2exp(-k
1t) + c
2 exp(-k
23t)
k
23 = k
2+k
3
c
2 = k
1c
1 / k
23-k
1
B
3(t) = c
31 exp(-k
1t)+c
32 exp(-k
23t) +c
3 exp(-k
45t)
k
45 = k
4 + k
5
c
3 = -c
31 -c
32
c
31 = k
2k
45-k
1
c
32=k
2c
2k
45-k
23
c
41 = k
4c
313c
2/-k
1
c
42=k
3c
2+k
4c
32/-k
23
c
43=k
4c
3+k
4c
32/-k
45
c
4 = - c
41- c
42- c
43
B
4(t) = c
41 exp(-k
1t)+c
42 exp(-k
23t) + c
43 exp(-k
45t)+c
4
c
51 = k
5c
31 / -k
1
c
52= k
5c
32 / -k
23
c
53= k
5c
3 / -k
45
c
5 = - c
51 - c
52 - c
53
B
5(t) = c
51 exp(-k
1t) + c
52 exp(-k
23t) + c
53 exp(-k
45t) + c
5
B
5(t) 也可以由(A.6)式算出。
(参考文献同
复杂气固催化过程之烷氧基硅烷的直接合成(1))
 图 4.1 醇-硅过程模拟运行图
全混流反应模型本质上就是这个模式。一个是固体,一个是气体,醇-硅过程当然不是均相的。但是,我们可以借用这个模型了解过程的某些特性。
在某一试验阶段使用这一模型了解过程的基本特性是必要的。后面我们再讨论如何修正这一实验模型。
图 4.1 中的醇指数是 t 时刻 各组分(Bi)所含甲基之和摩尔数计算值,
2B2+3B3+4B4+4B5。
它与醇的实际供给量(图中左下角至右上角的斜线)不重合,醇的缺失是假的,因为这些速率的模拟是随意假设的而不是测定的。
另一方面,这一现象反映过程的本质。有一个时刻,在这个时刻之前,醇处于饥饿状态,
反应处于激烈的竞争中。之后,竞争相对不激烈,以致逐渐消失。
由图 4.1 很清楚地看出,反应(4.1)-(4.5)是复杂反应,可以分为三组:
第一组:反应主要为(4.1)的引发生成 B2;
第二组:平行反应(4.1)、(4.3)竞争地发生,消耗醇和 B2 分别生成 B3 和 B4;
第三组: B3 出现之后,平行反应(4.4)、(4.5})发生,又竞争消耗醇和 B3 ,分别生成 B4 和 B5.
组间具有串反应性质。一旦 B2,B3 出现之后,这三组之间又互相竞争。竞争消耗醇和目标产物。组间已失去时序关系,发生恶性竞争。
存在一个时刻 t, B2 达到最大值, B3 随后达到最大值。B3 一旦出现, B4,B5 即获得出现的可能,
逐渐出现并迅速增加且不减。一旦 B5出现,就意味着有水出现了,系统将面临各种麻烦。
反应的控制在于醇。只要有醇,即使没有硅了,反应照样能够继续,直到全部组分变成 B4或 B5。
如果没有醇,即使有再多的硅,反应会立即停止,各种产物的浓度不会继续发生变化。
假定在某一时刻,停止加入醇。在系统逐渐消耗完剩余的甲醇之后,反应会停止。
过程开发的要求是使主产物浓度最高而副产物浓度较低。
其措施只能是选择一个恰当的时刻,停止加入醇使反应停止。将目标产物提取出来后再进入下一反应周期。
图 4.1 醇-硅过程模拟运行图
全混流反应模型本质上就是这个模式。一个是固体,一个是气体,醇-硅过程当然不是均相的。但是,我们可以借用这个模型了解过程的某些特性。
在某一试验阶段使用这一模型了解过程的基本特性是必要的。后面我们再讨论如何修正这一实验模型。
图 4.1 中的醇指数是 t 时刻 各组分(Bi)所含甲基之和摩尔数计算值,
2B2+3B3+4B4+4B5。
它与醇的实际供给量(图中左下角至右上角的斜线)不重合,醇的缺失是假的,因为这些速率的模拟是随意假设的而不是测定的。
另一方面,这一现象反映过程的本质。有一个时刻,在这个时刻之前,醇处于饥饿状态,
反应处于激烈的竞争中。之后,竞争相对不激烈,以致逐渐消失。
由图 4.1 很清楚地看出,反应(4.1)-(4.5)是复杂反应,可以分为三组:
第一组:反应主要为(4.1)的引发生成 B2;
第二组:平行反应(4.1)、(4.3)竞争地发生,消耗醇和 B2 分别生成 B3 和 B4;
第三组: B3 出现之后,平行反应(4.4)、(4.5})发生,又竞争消耗醇和 B3 ,分别生成 B4 和 B5.
组间具有串反应性质。一旦 B2,B3 出现之后,这三组之间又互相竞争。竞争消耗醇和目标产物。组间已失去时序关系,发生恶性竞争。
存在一个时刻 t, B2 达到最大值, B3 随后达到最大值。B3 一旦出现, B4,B5 即获得出现的可能,
逐渐出现并迅速增加且不减。一旦 B5出现,就意味着有水出现了,系统将面临各种麻烦。
反应的控制在于醇。只要有醇,即使没有硅了,反应照样能够继续,直到全部组分变成 B4或 B5。
如果没有醇,即使有再多的硅,反应会立即停止,各种产物的浓度不会继续发生变化。
假定在某一时刻,停止加入醇。在系统逐渐消耗完剩余的甲醇之后,反应会停止。
过程开发的要求是使主产物浓度最高而副产物浓度较低。
其措施只能是选择一个恰当的时刻,停止加入醇使反应停止。将目标产物提取出来后再进入下一反应周期。