16-05-2025 - Exercise - VSEPR and dipole moment [EN]-[IT]
Cover background image generated with AI, software used: copilot microsoft
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
[ENGLISH]
16-05-2025 - Exercise - VSEPR and dipole moment [EN]-[IT]
With this post I would like to provide some brief notions about the topic mentioned in the subject.
The context in which we operate is that of Chemistry
(code notes: MOD-90)
VSEPR and dipole moment
Exercise 01
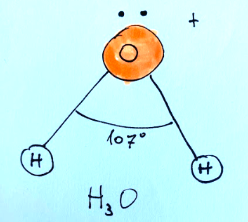
Predict the geometry of H3O+ (oxonium ion) using the VSEPR theory.
The basis for solving the following exercise
To understand molecular geometry we can combine two methods: Lewis theory + V.S.E.P.R. theory.
The acronym V.S.E.P.R. is the acronym for Valence Shell Electron Pair Repulsion.
This theory is a model used to predict the three-dimensional shape of molecules. The basic idea is that the electron pairs around the central atom repel each other and arrange themselves as far apart as possible to minimize the repulsion.
There are 3 phases of this method:
-Counting the electron pairs
-Determination of the geometric position
-Deduction of the molecular shape.
Initial reasoning
Oxygen has 6 valence electrons and in In H₃O⁺, it is bonded to 3 hydrogen atoms. We also consider that there is a positive charge, so we lose an electron.
We can deduce the valence electrons through the following reasoning.
6 (of oxygen) + 3 (of hydrogen) - 1 (positive charge)
give a result of 8 electrons, from which 4 electronic pairs will derive.
Execution
At this point we can think about the distribution of the electronic pairs.
-3 pairs are bonding, with hydrogen atoms H
-1 pair is non-bonding, which would be the even ion.
At this point we can derive the geometric shape. Knowing that with 4 total electronic pairs, i.e. 3 bonding and 1 non-bonding, the molecular shape is triangular pyramidal.
The result
The shape is trigonal pyramidal with the angles are slightly less than 109.5° (typical of the tetrahedron)
Exercise 02
Arrange the following molecules in order of increasing dipole moment: NH3, PH3, AsH3.
The basics for the following exercise
To do this exercise we need to clarify the concept of dipole moment.
Basically we can say that the dipole moment is a measure of the charge separation in a molecule.
What is charge separation?
Charge separation refers to the fact that the electrons are not distributed uniformly. However, this is not everywhere, but only in some molecules.
For example, in the water molecule (H2O), the electrons of the O–H bonds are closer to the oxygen and this creates a negative zone near the oxygen and a positive zone near the hydrogen atoms.
If the charges cancel each other out, the molecule is said to be symmetrical and therefore there is no charge separation.
The dipole moment depends on three factors:
-Difference in electronegativity between the central atom and the bonded atoms
-Geometry of the molecule
-Symmetry. Symmetry means whether the forces cancel each other out or add together.
Initial reasoning
We can start with the exercise by doing these three reasonings.
-These three molecules, according to the VSEPR theory, have a trigonal pyramidal shape.
-The three molecules have in common that they all have a central atom of group 15 (N, P, As)
-These three molecules have ter hydrogen atoms bonded.
Procedure
Let's start analyzing the three molecules:
Ammonia - NH₃
N is very electronegative (3.0), the P-H bonds are almost non-polar, in fact it has an asymmetric geometry
Phosphine - PH₃
P is less electronegative than the previous one (2.1), there is a strong polarity of the N-H bonds and the dipole moment is high, the dipole moment is much lower than the previous one even if the geometry is similar to that of NH₃
Arsine - AsH₃
As is even less electronegative (2.0). We went from 3.0 of N, to 2.1 of P until we get to that of As which is precisely 2.0. The As–H bonds are almost non-polar and even if here we have a geometry similar to the previous ones, we have an even lower dipole moment
The result
We can therefore provide a result. Below are the three molecules in order of increasing dipole moment.
AsH₃ < PH₃ < NH₃
Conclusions
The VSEPR method is a model that is used in chemistry to understand the three-dimensional shape of molecules.
Instead, to use even simpler words than those used in the post, we can say that The dipole moment is a measure of how much a molecule is "unbalanced" electrically. Basically, the greater the difference in charge and the distance between the poles, the greater the dipole moment.
Question
Did you know that the VSEPR method is still used today despite having been conceived more than 80 years ago by Nevil Sidgwick and Herbert Powell in 1940?

[ITALIAN]
16-05-2025 - Esercizio - VSEPR e momento dipolare [EN]-[IT]
Con questo post vorrei fornire alcune brevi nozioni a riguardo dell’argomento citato in oggetto.
Il contesto in cui operiamo è quello della Chimica
(code notes: MOD-90)
VSEPR e momento dipolare
Esercizio 01
Prevedere la geometria di H3O+ (ione ossonio) usando la teoria VSEPR.
Le basi per svolgere il seguente esercizio
Per comprendere la geometria molecolare possiamo abbinare due metodi: la teoria di Lewis + la teoria V.S.E.P.R.
La sigla V.S.E.P.R. è l’acronimo di Valence Shell Electron Pair Repulsion.
Questa teoria è un modello usato per prevedere la forma tridimensionale delle molecole. L’idea di base è che le coppie di elettroni attorno all’atomo centrale si respingono tra loro e si dispongono il più lontano possibile per minimizzare la repulsione.
Le fasi di questo metodo sono 3:
-Conteggio delle coppie di elettroni
-Determinazione della posizione geometrica
-Deduzione della forma molecolare.
Ragionamento iniziale
L’ossigeno ha 6 elettroni di valenza e in In H₃O⁺, è legato a 3 atomi di idrogeno. Inoltre consideriamo che c'è una carica positiva, quindi perdiamo un elettrone.
Possiamo dedurre gli elettroni di valenza tramite il seguente ragionamento.
6 (di ossigeno) + 3 (di idrogeno) - 1 (carica positiva)
danno un risultato di 8 elettroni, da cui ne deriveranno 4 coppie elettroniche.
Svolgimento
A questo punto possiamo pensare alla distribuzione delle coppie elettroniche.
-3 coppie sono leganti, con gli atomi di idrogeno H
-1 coppia non è legante, che sarebbe lo ione pari.
A questo punto possiamo derivare la forma geometrica. Sapendo che con 4 coppie elettroniche totali, cioè 3 leganti e 1 non legante, la forma molecolare è triangolare piramidale.
Il risultato
La forma è trigonale piramidale con gli angoli sono leggermente inferiori a 109,5° (tipico del tetraedro)
Esercizio 02
Disporre le seguenti molecole in ordine crescente di momento di dipolo: NH3, PH3, AsH3.
Le basi per svolgere il seguente esercizio
Per eseguire questo esercizio dobbiamo chiarire il concetto di momento dipolare.
Sostanzialmente possiamo dire che il momento dipolare è una misura della separazione di carica in una molecola.
Che cosa è la separazione di carica?
La separazione di carica si riferisce al fatto che gli elettroni non sono distribuiti in modo uniforme. Questo però non ovunque, ma solo in alcune molecole.
Ad esempio nella molecola dell’acqua (H2O), gli elettroni dei legami O–H sono più vicini all'ossigeno e questo crea una zona negativa vicino all'ossigeno e una zona positiva vicino agli atomi di idrogeno.
Se le cariche si annullano si dice che la molecola è simmetrica e quindi non c’è separazione di carica.
Il momento dipolare dipende da tre fattori:
-Differenza di elettronegatività tra atomo centrale e atomi legati
-Geometria della molecola
-Simmetria. Per simmetria si intende se le forze si annullano o si sommano.
Ragionamento iniziale
Possiamo iniziare con l’esercizio facendo questi tre ragionamenti.
-Queste tre molecole, secondo la teoria VSEPR, hanno una forma trigonale piramidale.
-Le tre molecole hanno in comune che tutte hanno un atomo centrale del gruppo 15 (N, P, As)
-Queste tre molecole hanno ter atomi di idrogeno legati.
Svolgimento
Iniziamo ad analizzare le tre molecole:
Ammoniaca - NH₃
N è molto elettronegativo (3.0), i legami P-H sono quasi apolari, ha infatti una geometria asimmetrica
Fosfina - PH₃
P è meno elettronegativo del precedente (2.1), c’è una forte polarità dei legami N-H ed il momento dipolare è elevato, il momento dipolare è molto più basso del precedente anche se la geometria è simile a quella di NH₃
Arsina - AsH₃
As è ancora meno elettronegativo (2.0). Siamo passati da 3.0 di N, a 2.1 di P fino ad arrivare a quello di As che è appunto 2.0. I legami As–H sono quasi non polari e se anche qui abbiamo una geometria simile a quelli precedenti, abbiamo un momento dipolare ancora più basso
Il risultato
Possiamo quindi fornire un risultato. Qui di seguito le tre molecole in ordine crescente di momento dipolare.
AsH₃ < PH₃ < NH₃
Conclusioni
Il metodo VSEPR è un modello che viene usato in chimica per comprendere la forma tridimensionale delle molecole.
Invece, per usare delle parole ancora più semplici di quelle usate nel post, possiamo dire che Il momento dipolare è una misura di quanto una molecola è "sbilanciata" elettricamente. In sostanza più è grande la differenza di carica e la distanza tra i poli, più è grande il momento dipolare.
Domanda
Lo sapevate che Il metodo VSEPR è usato ancora oggi nonostante sia stato stato ideato più di 80 anni fa da Nevil Sidgwick e Herbert Powell nel 1940?
THE END

La chimica è una delle materie che mi danno più mal di testa, in fisica mi trovavo meglio, per la chimica dovevo affidarmi ad altri compagni, c'è sempre qualcosa che ci rende più difficili da imparare
La chimica, eseguita solo in maniera teorica è difficile. Io sono stato agevolato dal fatto che a scuola avevamo un laboratorio di chimica bellissimo, quindi facevamo teoria e pratica allo stesso tempo. Secondo me, avere un laboratorio di chimica, aiuta a comprenderla meglio.
Upvoted! Thank you for supporting witness @jswit.